A causa dell’incidente avvenuto in Giappone alla centrale di Fukushima, abbiamo avuto modo di sentir parlare molto spesso di radiazioni, radioattività e radioprotezione.
Sebbene siano tutte parole ormai entrate nel gergo comune, usato da stampa e media con disinvoltura, è spesso difficile capire cosa veramente vogliano dire i numeri e le unità di misura legate a queste parole. In passato ho già scritto un post, generico, sugli effetti delle radiazioni ionizzanti sull’uomo. Oggi, invece, cominciamo con alcune definizioni.
La radioattività, o decadimento radioattivo, è la trasformazione spontanea di un nucleo in un altro nucleo, caratterizzato da minore energia. Il decadimento radioattivo è quindi accompagnato da un’emissione energetica atta a mantenere il bilancio energetico della reazione. Il modo in cui avviene la trasformazione del nucleo e il rilascio energetico è variabile, e dipende dalle caratteristiche del nucleo iniziale (per esempio se è ricco o povero di neutroni).
La trasformazione del nucleo, può avvenire per “decadimento alpha“, ovvero con rilascio di una particella alfa, che altro non è se non un nucleo di elio (due neutroni e due protoni). Questo decadimento ha luogo quando il rapporto tra neutroni e protoni è troppo basso. Poiché questa particella molto massiva deve liberarsi da un nucleo fermo, a riposo, deve “caricarsi” di tutta l’energia possibile per poter rompere la barriera di potenziale che la tiene legata al nucleo progenitore.
Per questa ragione il nucleo figlio non è quasi mai in stato eccitato (quasi qui è la parola chiave). Questo è importante perché se il nucleo è eccitato dovrà rilasciare energia e lo può fare in solo due modi: emissione di raggi gamma o conversione interna.
Oppure può avvenire per decadimento beta, ovvero con l’emissione di un elettrone.
La radiazione detta beta negativa consiste nell’emissione di un elettrone nucleare. Ricordiamo che questo elettrone non ha nulla a che vedere con gli elettroni atomici che vivono negli orbitali dell’atomo. Questi elettroni hanno provenienza direttamente dal nucleo, generati dalla trasformazione elementare di un neutrone in un protone. Per mantenere valido il computo dell’energia è necessario emettere anche un’altra particella durante questa reazione, il neutrino. A causa della bassissima capacità di interazione del neutrino con la materia, questa particella non è mai considerata durante i discorsi di radioprotezione.
Esistono anche nuclei che sono detti emettitori beta positivi. Questa radiazione è a prima vista molto strana. Si tratta infatti dell’emissione di un elettrone positivo (positrone) e di un neutrino, a conseguenza della trasformazione di un protone in un neutrone. La reazione è strana in quanto il neutrone, da solo, ha già un’energia superiore al protone.
Questa reazione quindi può accadere solo in nuclei con configurazioni di energie di legame molto particolari, tali che la reazione, nel suo complesso nucleare (non cioè a livello elementare) risulti avere un bilancio energetico positivo. Molto simile all’emissione beta è il decadimento radioattivo chiamato cattura K. In questo caso, il nucleo affamato di neutroni, se non riesce a trasformare un protone in neutrone via decadimento beta+, può catturare un elettrone atomico, nello specifico quello dell’orbitale K, che è il più basso.
L’elettrone può così interagire con un protone, per creare un neutrone e un neutrino. Cosa succede allora? C’è un “buco” tra gli elettroni atomici. Uno degli elettroni negli orbitali più energetici, quindi, si sente in dovere di scendere al livello K, e così facendo emette un fotone (generalmente nella frequenza dei raggi X).
Come accennato prima, quando un nucleo si trova in stato eccitato (per esempio come conseguenza delle reazioni di disintegrazione), emette energia sotto forma di “emissione gamma“. Questi raggi gamma non sono altro che fotoni. Le particelle che compongono il nucleo sono disposte in livelli energetici, proprio come accade per gli elettroni attorno al nucleo.
Quando il nucleo si diseccita emette quanti di energia (fotoni) in corrispondenza dei livelli energetici. Vi sono anche nuclei che sono, naturalmente, emettitori gamma. In questo caso il nucleo eccitato non è propriamente instabile, ma si dice “metastabile”. Un tipico caso è il Cesio 137, con un’emivita di 30.17 anni, emettendo un fotone a 662 keV (in questo caso, si dice radiazone X “dura”, e non gamma, che è definta nell’ordine dei MeV). Può anche succedere che un nucleo emetta un raggio gamma in conseguenza ad un’emissione beta positiva. Se il positrone emesso, infatti, incontra un elettrone, la sua anti-particella, si annichilisce, trasformando l’energia delle due particelle in un fotone.
Un altro modo di dis-eccitamento del nucleo è la conversione interna. In questo caso il nucleo trasferisce la propria energia in eccesso ad un elettrone orbitale (di solito dell’orbitale K o L) che a sua volta si eccita e viene espulso dall’atomo. Di nuovo, prendiamo l’esempio del Cesio 137. Esso si trasforma per emisisone beta- in Bario137 eccitato (la cui vita media è 2.55 minuti).
Nel 94,4% dei casi questo si disecciterà emettendo un fotone gamma (i 662 keV di prima). Nel 10.6% dei casi questo fotone darà luogo a conversione interna. Quando l’elettrone è espulso, deve essere sostituito da un altro elettrone, che precipita ed emette un fotone. Questo fotone, meno energetico, può a sua volta “scalzare” un elettrone orbitale. Questo elettrone viene detto ” effetto Auger“, ma non è interessante nel computo della radioprotezione perché non è rischioso per l’uomo.
Quando si parla di nuclei radioattivi si cita spessi il tempo di dimezzamento, o emivita. La ragione è che questo numero è una caratteristica imprescindibile del nucleo, non modificabile. Se contiamo il numero di decadimenti al minuto di un nucleo, noteremo come dopo un certo tempo questo numero verrà dimezzato. Prendiamo per esempio lo iodio131. Facciamo una misura della sua attività oggi, e la ripetiamo di giorno in giorno. Noteremo che dopo 8 giorni questo numero sarà ridotto della metà. Dopo altri 8 giorni, avremo di nuovo la metà, e così via. Tutti i processi radioattivi seguono questa legge.
Quando prendiamo una quantità di un elemento, per sapere quandi nuclei ci sono dobbiamo moltiplicare il numero atomico (ovvero il numero di nucleoni: nell’uranio238 è 238) per il Numero di Avogadro. Verremmo così a sapere che un grammo di uranio 238 contiene 2.5×10^{21} nuclei di uranio. La quantità di materia non corrisponde però alla quantità di radioattività. Se prendiamo il Torio234, che ha un peso atomico molto simile, vedremo che la sua radioattività è molto diversa. Infatti poiché l’emivita del torio è di soli 24.1 giorni, al contrario dei 4.5×10^9 anni dell’uranio, per avere la stessa quantità di radioattività tra i due elementi dovremmo prendere 1 grammo di torio e ben 680000 tonnellate di uranio! Per questo quando si parla di isotopi su vuole avere un’idea della loro attività e non solo della quantità di isotopo che abbiamo. L’unità standard (SI) della quantità di elementi radioattivi (attività) è il bequerel (Bq), definito come quella quantità di isotopo che dà luogo a una disintegrazione al secondo. In passato (ma ancora oggi fuori dall’ambito scientifico) si usava il Curie (Ci), definito come l’attività corrispondente a una massa di 1g di Radio226. La conversione tra curie e bequerel è: 1Ci = 3.7×10^{10}Bq (per convenzione il fattore di conversione è esattamente 3.7×10^{10}).
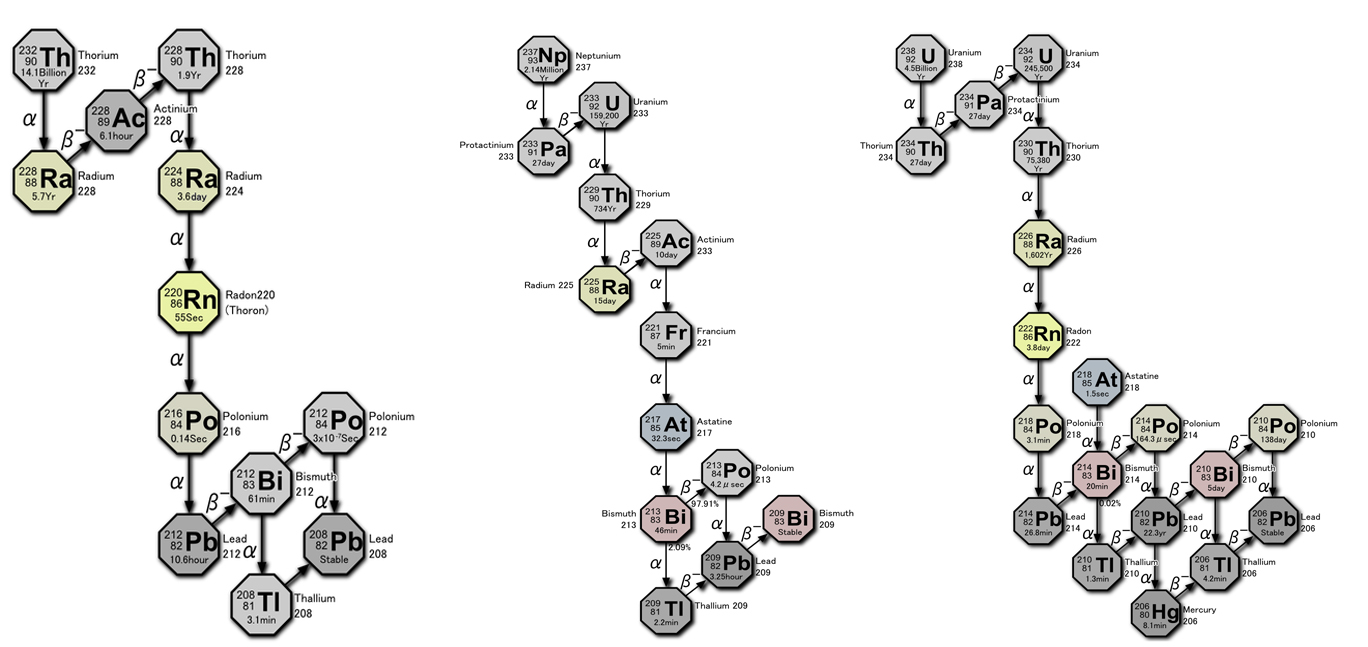
Se accanto ad un nucleo che decade vi è un’altra sorgente di attività (per esempio il nucleo figlio è anch’esso instabile) il computo della radioattività totale sarà più complesso. In questo caso, per sapere l’attività finale del sistema, è necessario risolvere delle equazioni differenziali. Un esempio di tale sistema sono le catene di decadimento naturali. Una catena di decadimento ha luogo quando il prodotto del decadimento di un nucleo è a sua volta radioattivo. Vi sono in natura tre grandi famiglie, più una estinta, generate a partire da un nucleo capostipite che decade in un nucleo instabile, che a sua volta produce un nucleo instabile, e così via, fino a quando non si produce un nucleo stabile. Tutte le famiglie, tranne quella estinta, finiscono in un isotopo del Piombo. Le famiglie sono illustrate nella figura qui sotto.
La prima serie è quella del Torio, che parte dal Torio232, con una vita di dimezzamento di 1.39×10^10 anni. Questa serie si conclude con il Piombo208, stabile. Tra gli elementi generati in questa catena c’è il Radon220. Questo elemento è presente in natura sotto forma gassosa e con una vita media di soli 3.8 giorni. È un emettitore alpha e quindi può essere pericoloso. Come vedremo nei prossimi post, infatti, sebbene le particelle alpha non siano in grado di attraversare materiali, possono essere pericolose se l’emettitore è ingerito, come può accadere respirando Radon. La seconda famiglia è quella dell’Uranio, che ha come capostipite l’Uranio238. Da notare come anche questa catena contenga il Radio226 che decade dopo 1602 anni in Radon222. La terza serie è quella dell’Attinio, che comincia con l’Uranio235. Poiché l’Uranio235 ha un tempo di dimezzamento relativamente breve se confrontato con la vita dell’Universo, gli elementi presenti in questa catena sono estremamente rari in natura (la proporzione attuale di Uranio235 in natura è 0.25%).
L’ultima famiglia è quella del Nettunio (Np237), il primo dei transuranici, con una vita media di “appena” 2.25×10^6 anni. A causa della vità così breve del capostipite di questa famiglia, rispetto alla vita dell’Universo, i mebri di questa serie sono quasi tutti estinti. È però possibile ricreare il Np237 in laboratorio, ridando vita a questa famiglia.
Adesso che sappiamo come funzionano i decadimenti radioattivi, ci troviamo a dover capire le particelle emesse in questo modo: le alpha, beta e gamma.
Quando una particella attraversa della materia, rilascia energia. Per ogni particelle si può definire una quantità chiamata “stopping power” ovvero la quantità di energia che perde per unità di lunghezza (dE/dX). Questa quantità è importantissima in quanto da essa dipende il tipo di schermatura necessario per una particella, ma anche l’effetto che ha sul corpo umano.
Una particella alpha, per esempio, può percorrere solo 6/7 cm in aria, prima di perdere tutta la propria energia e scomparire. Così, un elettrone beta, potrà percorrede circa 5/7 metri. I fotoni invece possono percorrere diversi chilometri in aria, prima di perdere la propria energia.
Ma questo, lo vedremo nel prossimo post!